Tipos de orbitales.
Es el denominado modelo mecánico-cuántico, que fue establecido por Edwin Schrödinger (1887-1961). Los estudios de Schrödinger demostraron que existen distintos tipos de orbitales, región del espacio en la que existe una probabilidad máxima de encontrar el electrón, que se identifican con las letras: s, p, d y f. La forma y el tamaño dependen del nivel y del subnivel de energía en que se encuentra, así:
Los orbitales s tienen forma esférica.
Los orbitales p tienen forma de ocho (8).
Los orbitales d y f tienen formas más complejas.
El tipo de orbitales que hay en cada nivel también está determinado:
En el primer nivel solo hay un orbital de tipo s.
En el segundo nivel hay orbitales de tipo s y p.
En el tercer nivel hay orbitales s ,p y d.
En el cuarto nivel y en los siguientes hay orbitales de tipo s ,p , d y f.
Configuración electrónica.
La configuración electrónica muestra los distintos niveles y subniveles energéticos ocupados, junto con el número de electrones que existe en los mismos.
Número de electrones por capa o nivel es igual a 2*n2
| Capas o nivel | Nº electrones máximos | electrones por orbitales |
| 1 | 2*n2, 2*(1)2 = 2 | s2 |
| 2 | 2*n2, 2*(2)2 =8 | s2p6 |
| 3 | 2*n2, 2*(3)2 =18 | s2 p6d10 |
| 4 | 2*n2, 2*(4)2 =32 | s2 p6 d10 f14 |
| 5 | 2*n2, 2*(5)2 = 50 | s2 p6 d10 f14 g18 |
| 6 | 2*n2, 2*(6)2 =72 | s2 p6 d10 f14 g18… |
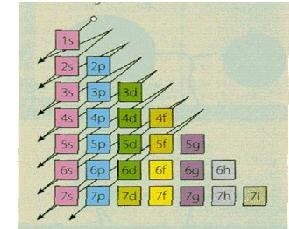
Configuración electrónica del sodio:
Sodio (Na) con número atómico Z = 11, es decir, 11 protones, 11 neutrones y 11 electrones, los electrones se distribuyen en los siguientes orbitales:
1 s2
2 s2 p6
3 s1
En la siguiente escena puedes corregir tus configuraciones electrónica.
A continuación se puede observar la distribución de los electrones en distintos átomos de la tabla periódica, sólo debes elegir el átomo y comprobarás el modelo.