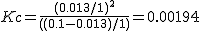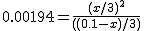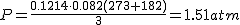El Equilibrio Químico. Autoevaluación
Actividad 3.9
Se introducen 0.1 moles de SbCl5
en un recipiente de 1 litro, se calientan a 182°C y se produce su
disociación: SbCl5 (g) 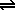 SbCl3 (g) + Cl2(g),
quedando cuando se alcanza el equilibrio 0.087 moles de SbCl5:
SbCl3 (g) + Cl2(g),
quedando cuando se alcanza el equilibrio 0.087 moles de SbCl5:
La constante de
equilibrio Kc es de 7.23
| |
La constante de
equilibrio Kc es de 1.94·10-3
| |
Si se aumenta el volumen
de 1 a 3 litros, manteniendo la temperatura
constante, las
concentraciones de reactivos y productos en el equilibrio serán 0.0262 M y
0.0071 M, respectivamente | |
Si se aumenta el volumen
de 1 a 3 litros, manteniendo la temperatura
constante, las
concentraciones de los productos en el equilibrio serán 0.016 y
0.07
| |
La presión total
de la mezcla en las condiciones finales cuando se aumenta el volumen a 3 L será de 1.51 atm
| |
La presión total
de la mezcla en las condiciones finales cuando se aumenta el volumen a 3 L será de 3.5 atm
| |
Este artículo está licenciado bajo Creative Commons Attribution-NonCommercial 2.5 License