

| Formulación Inorgánica | ||
| Enrique Pescador Canora |
|
Imprimir |
| Óxidos | Objetivos |
|
Son compuestos binarios formados entre el oxígeno y cualquier otro elemento (a excepción del flúor). El oxígeno siempre tiene valencia negativa (-2), así que el otro elemento debe tener valencia positiva, así que este último puede ser tanto un metal como un no metal. El procedimiento para formar el compuesto es como se ha explicado en la sección anterior, aunque hay que tener en cuenta que si el otro elemento tiene una valencia par, se debe simplificar la fórmula. Veamos qué pasaría si el oxígeno con valencia -2 se une, por ejemplo, con el carbono con valencia +4. Como puede verse, el compuesto formado es el CO2, en vez del C2O4. Para nombrar los óxidos se sigue el siguiente esquema: [prefijo]óxido de [prefijo]elemento donde el prefijo
indica el número de átomos correspondiente.
Veamos algunos ejemplos: 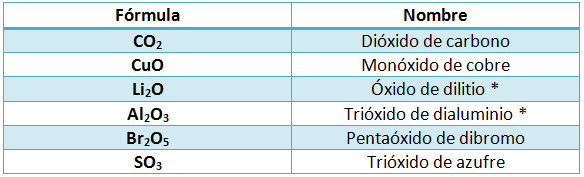 En los casos
marcados con
asterisco, el elemento que se une al oxígeno sólo
tiene
una valencia y se pueden quitar los prefijos, ya que no hay
confusión (sólo hay un óxido posible
para dicho
elemento).
|
|