|
Arrhenius definió los ácidos como electrolitos que contienen hidrógeno y que, disueltos en agua, producen una concentración de iones hidrógeno o protones, H+, mayor que la existente en el agua pura. Del mismo modo, Arrhenius definió una base como una sustancia que disuelta en agua producía un exceso de iones hidróxido, OH- (también llamados aniones hidroxilo).
La teoría de Arrhenius ha sido objeto de críticas. La primera es que el concepto de ácido se limita a especies químicas que contienen hidrógeno y el de base a las especies que contienen iones hidróxido. La segunda crítica es que la teoría solo se refiere a disoluciones acuosas, cuando en realidad se conocen muchas reacciones ácido-base que tienen lugar en ausencia de agua.
Ácidos de Arrhenius: |
{ |
H2SO4 |
→ |
HSO4- |
+ |
H+ |
| HAc |
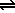 |
Ac- |
+ |
H+ |
Base de Arrhenius: |
NaOH |
→ |
Na+ |
+ |
OH- |
|


