|
La distinción entre ácidos fuertes y débiles depende tanto del disolvente como de las propiedades de los propios ácidos. Un ácido cederá fácilmente protones en un disolvente que tenga fuerte tendencia a captarlos, comportándose como ácido fuerte en este caso. Si el disolvente tiene poca tendencia a captarlos, este ácido actuará como débil frente a este disolvente. Se puede hacer el mismo razonamiento con las bases.
Por tanto, si queremos establecer una lista para comparar la fuerza de los diferentes ácidos, la tendremos que hacer usando el mismo disolvente. Se escogió para tal fin el agua.
Un ácido en disolución acuosa se disocia según el siguiente equilibrio:
HA |
+ |
H2O |
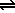 |
H3O+ |
+ |
A- |
| Ácido1 |
|
Base2 |
|
Ácido2 |
|
Base1 |
la constante de este equilibrio será:
Cuanto mayor sea ka, más fuerte será el ácido. |


