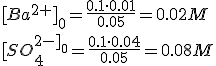El BaCl2(s) es soluble:
| BaCl2(s) |
→ |
Ba2+(ac) |
+ |
2 Cl−(ac) |
| |
|
0.1 M
|
|
0.2 M |
El Na2SO4(s) es soluble:
Na2SO4(s)
|
→
|
2 Na+(ac)
|
+ |
SO42-(ac) |
| |
|
0.2 M |
|
0.1 M |
Para que precipite BaSO4(s) se deberá cumplir:
[Ba2+]0·[SO42-]0 ≥ 1.1·10-10
Como ahora el volumen es de 50 ml (debido a la unión de los dos volúmenes)
Como 0.02·0.08 > 1.1·10-10, precipitará BaSO4
Para saber cuanto sulfato de bario precipita podemos plantear el equilibrio:
| |
BaSO4(s) |
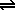
|
Ba2+(ac)
|
+
|
SO42-(ac)
|
| Inicial |
|
|
0.02 |
|
0.08 |
| Equilibrio |
|
|
0.02 - x
|
|
0.08 - x
|
1.1·10-10 = (0.02-x) (0.08-x)
Al ser Ks muy pequeño prácticamente todo el BaSO4(s) que pueda formarse precipitará, la [Ba2+] y la [SO42-] son muy pequeñas y la ecuación de 2ºgrado dará soluciones poco satisfactorias.
Un modo mejor de resolver el problema consiste en:
1. Suponer que precipita todo el BaSO4(s) posible (como si la precipitación fuera completa).
2. Parte del BaSO4(s) se disuelve hasta alcanzar el equilibrio de solubilidad:
| |
BaSO4(s) |
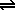 |
Ba2+(ac) |
+ |
SO42-(ac) |
| 1. Inicial |
|
|
0.02
|
|
0.08 |
Final
|
|
|
≈ 0 |
|
0.06 |
| |
|
|
|
|
|
| 2. Inicial |
|
|
0 |
|
0.06 |
| Equilibrio |
|
|
x |
|
0.06 + x
|
1,1·10-10 = x (0.06+x) ≈ x·0,06
x = 18.3·10−10 M
En definitiva: [Ba2+] = 18.3·10-10 M
[Na+] = 0.16 M
[SO42-] = 0.06+x ≈ 0,06 M
[Cl−] = 0.04 M
Y el número de moles de BaSO4(s) que precipitan =(0.02-x)·0.05 ≈ 0.001 moles