 Pregunta de Selección Múltiple
Pregunta de Selección Múltiple
La solubilidad del PbF2 en una disolución 0.25 M de nitrato de plomo(II) es:
Dato: Ks(PbF2) = 4·10−8
La disolución correspondiente a la sustancia soluble dará lugar a:
|
Pb(NO3)2(s) |
→ |
2 NO3− (ac) + |
Pb2+(ac) |
| |
|
2·0.25 M
|
0.25 M |
El equilibrio de solubilidad de la sustancia poco soluble, que estará influido por la anterior reacción, por tener un ion común sería:
PbF2(s) 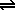 2 F−(ac) + Pb2+(ac)
2 F−(ac) + Pb2+(ac)
Ks = [F−]2 [Pb2+]
4·10−18 = (2S)2 (0.25+S); Como Ks es pequeño: 0.25+S ≈ 0.25
4·10−18 = 4·S2·0.25
S = 2·10−4 M

|

Este artículo está licenciado bajo Creative Commons Attribution-NonCommercial 2.5 License