Ya hemos visto que un sistema termodinámico puede intercambiar energía con su entorno en forma de trabajo, de calor o de ambos aumentando o disminuyendo su energía interna. El primer principio de la termodinámica establece la relación entre estas tres magnitudes y no es más que la aplicación del principio de conservación de la energía a los sistemas termodinámicos.
Escribamos el principio de conservación de la energía en el caso de que exista trabajo externo:
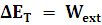
Como hemos visto, si un sistema absorbe calor también aumenta la energía total de éste:
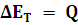
Si hay realización de trabajo y absorción de calor:
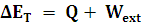
Ahora, si tenemos en cuenta que la energía interna es la suma de todas las energías de las partículas que tiene el sistema (recuerda que se excluyen las energías cinética y potencial del sistema tomado como un todo), la ecuación anterior quedará:
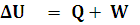
Si trabajamos con un gas, el trabajo de las fuerzas externas es el mismo que el realizado por el gas pero cambiado de signo: si el gas se expande, como el sistema pierde energía interna, lo consideraremos negativo en la ecuación anterior y positivo si el trabajo se realiza sobre el sistema. Del mismo modo, si el calor es absorbido por el sistema lo consideraremos positivo y si es cedido al entorno negativo.
|


