El enlace de hidrógeno en el agua
Las fuerzas intermoleculares en el agua son mucho mayores de lo que cabría esperar de su composición. Esto puede ponerse de manifiesto si se estudian los puntos de fusión o de ebullición de los hidruros de los anfígenos. El punto de fusión del agua es mucho más alto de lo que debería y lo mismo ocurre con su punto de ebullición, lo que indica que hay una fuerza intermolecular muy intensa entre las moléculas de agua.
El enlace o puente de hidrógeno se produce cuando hay un enlace covalente entre el hidrógeno y el flúor, el oxígeno o el nitrógeno. La polaridad de este enlace, junto con el poco tamaño de los átomos que hace que se puedan acercarse mucho, permiten al hidrógeno fluctuar de una molécula a otra, aumentando su unión.
El puente de hidrógeno es una fuerza intermolecular muy común en las sustancias biológicas y es responsable de muchas de las propiedades y la estructura tridimensional de las biomoléculas, como proteínas o ácidos nucleicos. De hecho, es la formación de puente de hidrógeno lo que da su estructura al ADN y ocasiona que la base citosina esté siempre enfrentada con la molécula de guanina y la de timina con la adenina en la doble hélice del ADN.
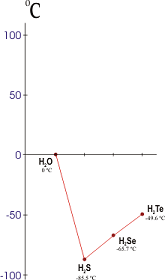
Puntos de fusión de los hidruros del grupo del oxígeno. (El agua debería congelar a menos de -100ºC).
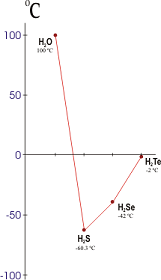
Puntos de ebullición de los hidruros del grupo del oxígeno. (El agua debería hervir a menos de -50ºC).