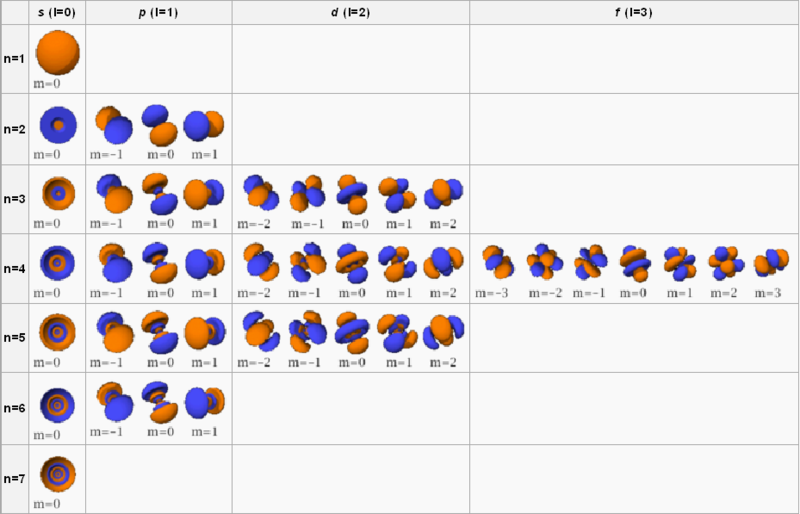
Orbitales atómicos
El modelo mecano-cuántico del átomo es un modelo matemático basado en la Ecuación de Schrödinger. Las soluciones son unos números llamados números cuánticos. Se simbolizan de la siguiente forma:
n: Número cuántico principal. Toma valores desde enteros positivos, desde n = 1 hasta n = 7. Nos indica la energía del orbital y su tamaño (cercanía al núcleo).
l: Número cuántico secundario o azimutal. Toma valores desde 0 hasta (n-1). Nos indica la forma y el tipo del orbital.
- Si l = 0 el orbital es tipo s. (Se presentan de 1 en 1).
- Si l = 1 el orbital es tipo p. (Se presentan de 3 en 3).
- Si l = 2 el orbital es tipo d. (Se presentan de 5 en 5).
- Si l = 3 el orbital es tipo f. (Se presentan de 7 en 7).
m: Número cuántico magnético. Toma valores desde -l hasta +l pasando por 0. nos indica la orientación espacial del orbital.
s: Número cuántico de spin. Toma valores -1/2 y 1/2. Nos indica el giro del electrón en un sentido o el contrario.
Por ejemplo, si n = 1 entonces l = 0 sólo hay un orbital, el 1s. Si n = 2, tenemos l = 0 (1 orbital 2s) y l = 1 (3 orbitales 2p). Si n = 3, tenemos l = 0 (1 orbital 3s), l = 1 (3 orbitales 3p) y l = 2 (5 orbitales 3d). Si n = 4, tenemos l = 0 (1 orbital 4s), l = 1 (3 orbitales 4p), l = 2 (5 orbitales 4d) y l = 3 (7 orbitales 4f).