Recordemos que, planteamos que la presión de un gas en un recipiente iba a depender de: el volumen del mismo, de la temperatura y del nº de partículas del gas. Las experiencias planteadas nos permitieron llegar a las siguientes leyes:
1ª Experiencia: A t=constante y nº de partículas del gas=constante,
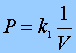 Ley de Boyle. Ley de Boyle.
2ª Experiencia: A V= constante y nº de partículas del gas constante,
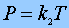 Ley de Gay Lussac Ley de Gay Lussac
Es decir, la presión de un gas es directamente proporcional a la temperatura absoluta del gas e inversamente proporcional al volumen del recipiente. Todo esto para un nº de partículas del gas constante, es decir para una determinada cantidad de gas. Esto último podemos expresarlo así:
Pasar a la Página siguiente
|
|









