|
Antecedentes históricos: Los filósofos griegos,
Demócrito y Epicuro, consideraban que la materia es divisible en la experiencia diaria, pero, en un cierto término, consta de partículas indivisibles que podemos provisionalmente llamar átomos (de la palabra griega átomo, indivisible).
El físico inglés J. Dalton (1766-1844) establece la Teoría atómica de la materia en la que se considera que todo tipo de materia, sea sólido, líquido o gas, está constituida por partículas, que en principio se llamaron átomos.
En un SÓLIDO, estas "partículas" ocupan posiciones determinadas en una red, alrededor de las cuales vibran cada vez más intensamente a medida que aumentamos la temperatura. Las fuerzas atractivas entre las partículas del sólido son muy intensas.
En un LÍQUIDO, estas "partículas" se mueven
deslizándose unas cerca de otras y manteniéndose unidas por débiles fuerzas atractivas entre ellas.
En el caso de un GAS, estas "partículas" se mueven a grandes velocidades y las fuerzas atractivas entre ellas podemos considerarlas como inexistentes. Se mueven al azar ocupando todo el volumen del recipiente.
|
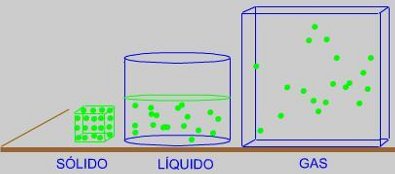
Haz clic sobre la imagen para ver las partículas de cada cuerpo en movimiento.
¿Ves las diferentes características de este movimiento según el estado en que se encuentre la materia?
En las páginas siguientes trataremos de entender el comportamiento de las partículas de los gases.
|









