Calor a volumen constante. En termodinámica llamamos transformación isócora a la que transcurre sin cambio en el volumen del sistema. Muchas reacciones en química transcurren sin un cambio apreciable en el volumen: neutralización de una base con un ácido en disolución acuosa... A la absorción o emisión de calor en estas condiciones la denominamos calor a volumen constante. Si recordamos el primer principio de la termodinámica, vemos que en este caso la variación de energía interna coincide con el calor a volumen constante ya que no hay realización de trabajo al no variar el volumen del sistema:
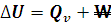
Calor a presión constante. En termodinámica llamamos transformación isóbara a la que transcurre sin variación en la presión, este es el caso de muchísimas reacciones químicas que se producen en el laboratorio a presión atmosférica y que implica el concurso de gases. En este caso sí que puede haber realización de trabajo, por lo que deberemos tenerlo en cuenta al utilizar el primer principio de la termodinámica. El calor absorbido o cedido en estas reacciones recibe el nombre de entalpía de reacción (∆H).
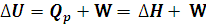
Si trabajamos con gases a presión constante, el trabajo realizado se deberá a la variación producida en su volumen, por tanto podemos escribir:
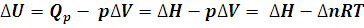
Donde ∆n es la variación en el número de moles de gas producida en la reacción.
|


