Como hemos dicho, en un proceso químico reversible al final de la reacción se obtiene una mezcla de reactivos y de productos que continúan reaccionando aunque sus concentraciones se mantengan constantes (equilibrio dinámico).
En un sistema en equilibrio, la variación de energía libre de Gibbs es cero. Por tanto, en el equilibrio químico:
∆G = 0
Al estudiar el equilibrio químico deberemos conseguir conocer las concentraciones de todas las especies presentes en él y cuáles son las condiciones que favorecen que se produzcan más o menos productos.
En el applet puedes visualizar el proceso seguido hasta el equilibrio de la siguiente reacción:
CO(g) + 3 H2(g) 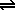 CH4(g) + H2O(g) CH4(g) + H2O(g)
|


