LAS
FUERZAS INTERMOLECULARES
Podemos hablar de dos
tipos de fuerzas
intermoleculares:
Los
puentes
de hidrógeno
son
enlaces debidos a dipolos
muy intensos que se dan cuando se une el hidrógeno con
estos tres elementos muy electronegativos: nitrógeno, oxígeno y
fluor.
Son interacciones bastante fuertes
por lo que confieren a las
sustancias puntos de fusión y ebullición más altos de los esperados.
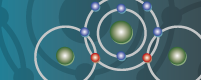
Puedes ver, en el caso del agua,
cómo se unen las moléculas: